有害事象/副作用発現率、発現時期及び適正使用の目安
エスワンタイホウ単独療法
主な副作用発現率(n=134)
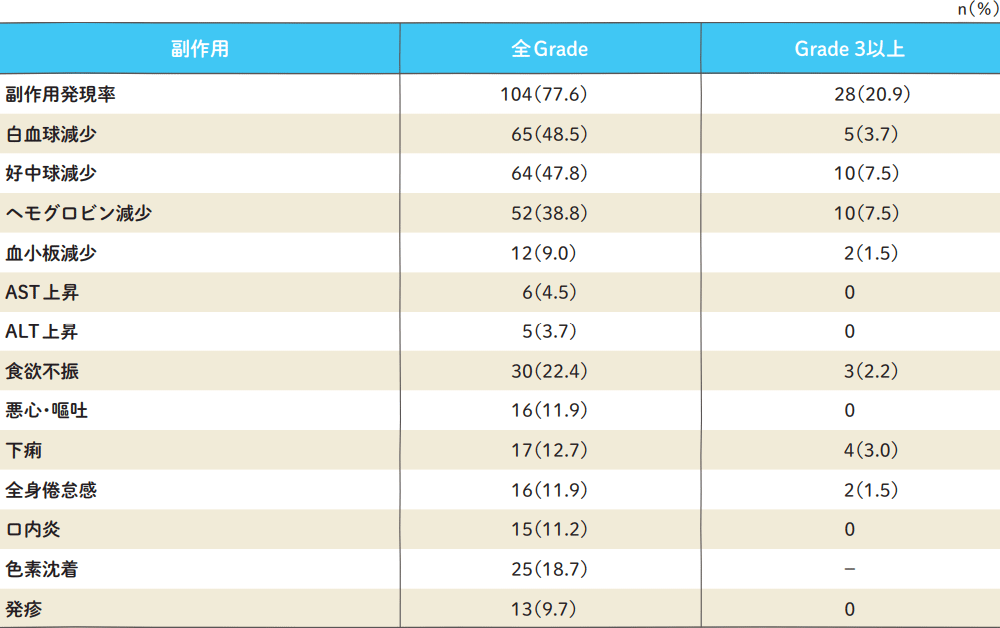
Grade分類は、日本癌治療学会基準で集計
Sugimachi K, et al. Oncology. 1999; 57(3): 202-210(ティーエスワンの承認時評価資料)
進行・再発胃癌/ 大腸癌に対するS-1単独療法の前期臨床第Ⅱ相試験
Sakata Y, et al. Eur J Cancer. 1998; 34(11): 1715-1720(ティーエスワンの承認時評価資料)
Koizumi W, et al. Oncology. 2000; 58(3): 191-197(ティーエスワンの承認時評価資料)
進行胃癌に対するS-1単独療法の後期臨床第Ⅱ相試験
副作用発現時期の目安と対応のポイント
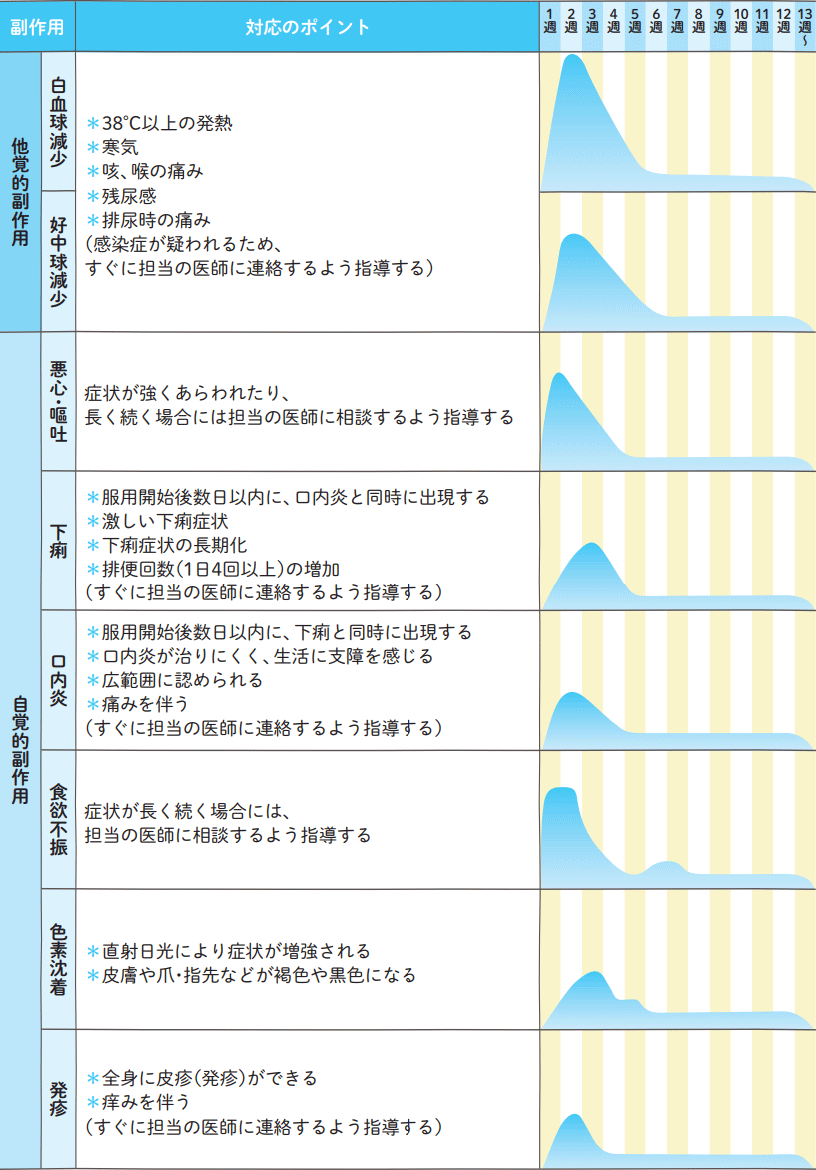
・山のピークは分布であり、症状の程度ではない。
・ティーエスワン胃癌使用成績調査(3808例)より作成した。
適正使用の目安
ULN:(施設)基準値上限
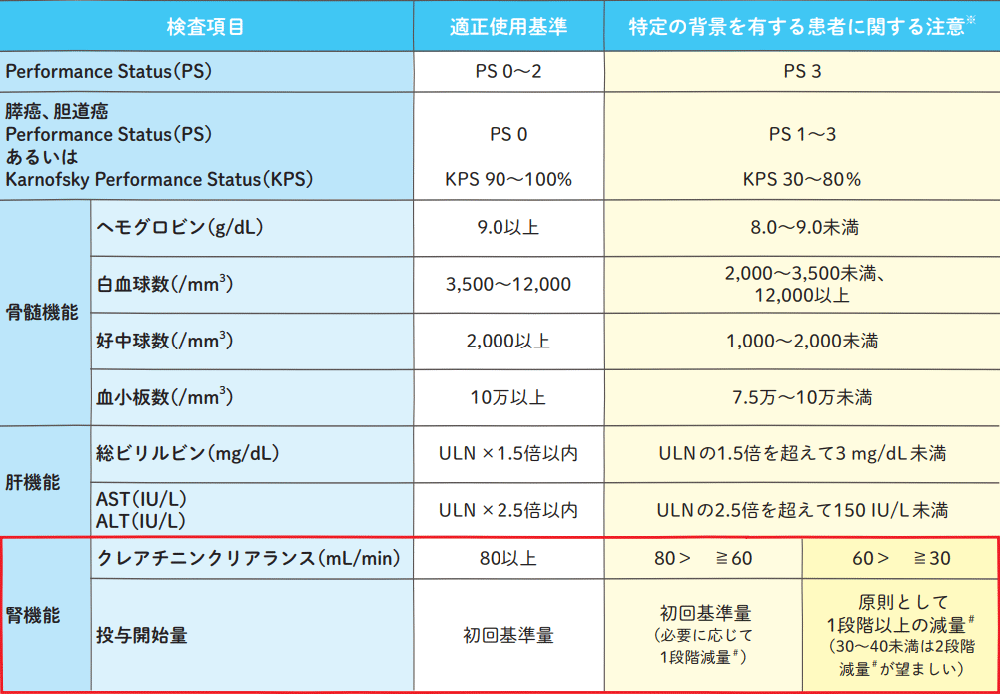

投与開始量は、クレアチニンクリアランス(実測値あるいは推定値)だけで定まるものではなく、患者の状態によっては80 mL/min以上の症例であっても減量が必要な場合もある。
クレアチニンクリアランス実測値がない場合は、クレアチニンクリアランス推定値を用いてください。
| [Cockcroft-Gault式] | ||
|
クレアチニンクリアランス推定値 (mL/min) |
= | (140-年齢)×体重(kg) |
| 72×血清クレアチニン値(mg/dL) | ||
| (女性の場合は さらに得られた値を0.85倍にする) |
※:適正使用基準に回復するまで投与延期することが望ましく、本剤の投与を必要とする場合には頻回に検査し、慎重に観察しながら投与する。
#:先発品(ティーエスワン)の承認治験においては、最低投与量は40 mg/回としていた。
注:重篤な骨髄抑制のある患者、重篤な腎障害のある患者、重篤な肝障害のある患者には投与しないこと。
休薬・減量・再開の目安
ULN:(施設)基準値上限 ( ):目安となる検査値の絶対値 TPN:非経口栄養
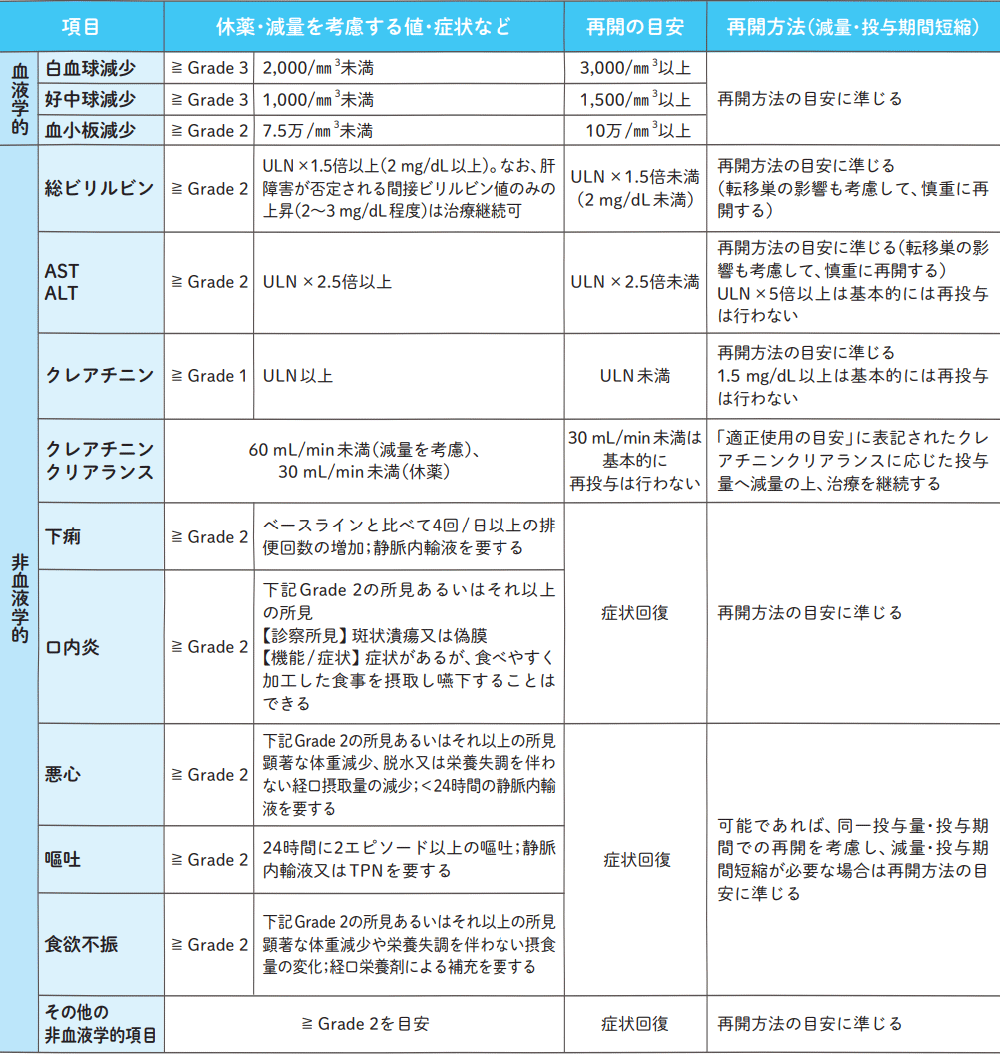
再開方法の目安

注1:休薬を考慮する値・目安のGradeはCTCAE v3.0をベースにエスワンタイホウ適正使用の目安を基に一部変更を加えて作成。
注2:休薬・減量・再開の目安であって、絶対的なものではないため、患者の状態や発現時期などを考慮して休薬や再開を決定。
エスワンタイホウの使用にあたっては用法及び用量をご参照ください。

