有害事象/副作用発現率、発現時期及び適正使用の目安
エスワンタイホウ+イリノテカン+ベバシズマブ療法
主な有害事象発現率(n=239)
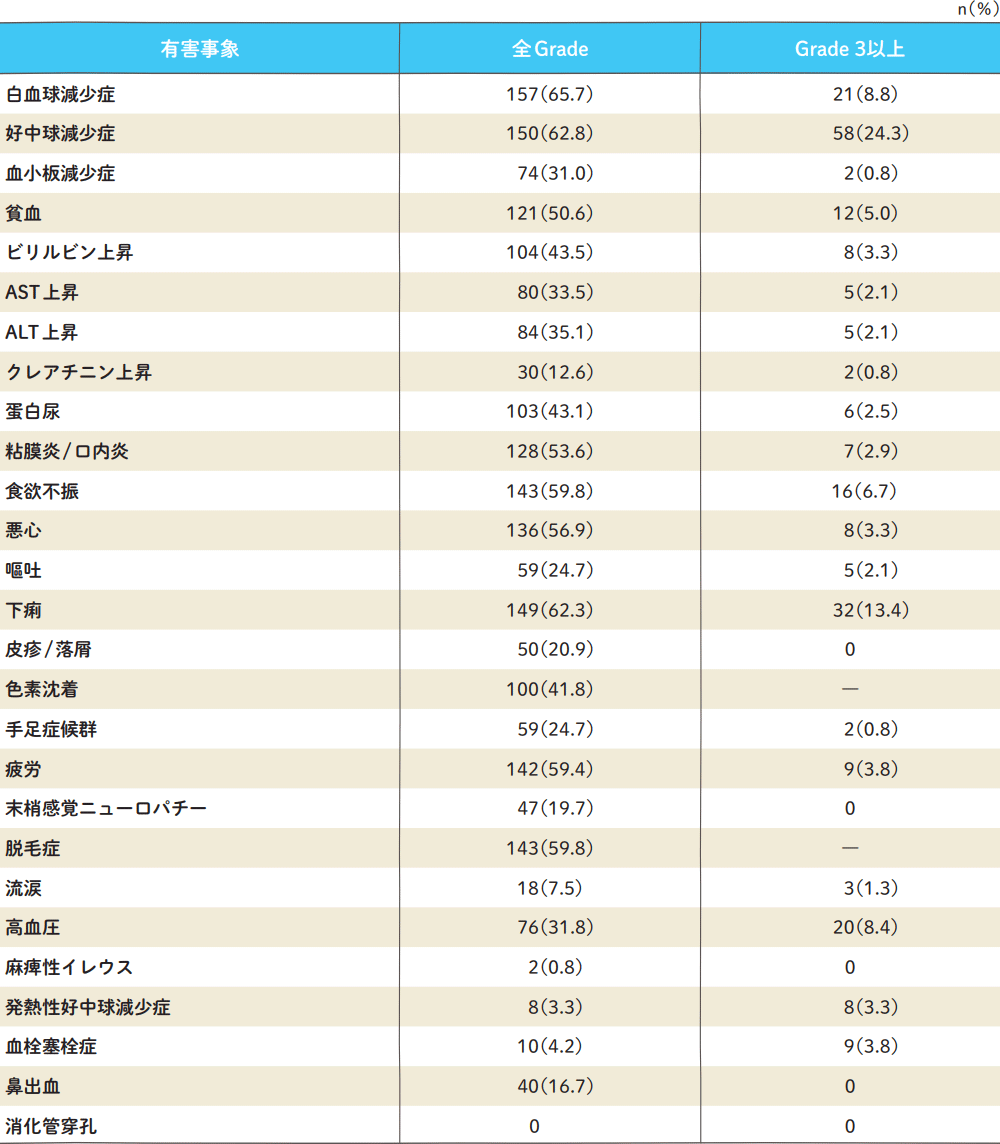
Grade分類は、CTCAE v4.0で集計
Komatsu Y, et al. BMC Cancer. 2015; 15: 626
Yamada Y, et al. Ann Oncol. 2018; 29(3): 624-631
コース内休薬・再開基準
エスワンタイホウ投与期間中に以下の休薬基準に1つでも該当した場合、エスワンタイホウを休薬する。休薬後は再開基準を満たすことを確認後、「減量・中止基準」に従ってエスワンタイホウを再開する。ただし、エスワンタイホウを休薬し15日目までに再開基準を満たさなかった場合、次コース開始まで休薬する。
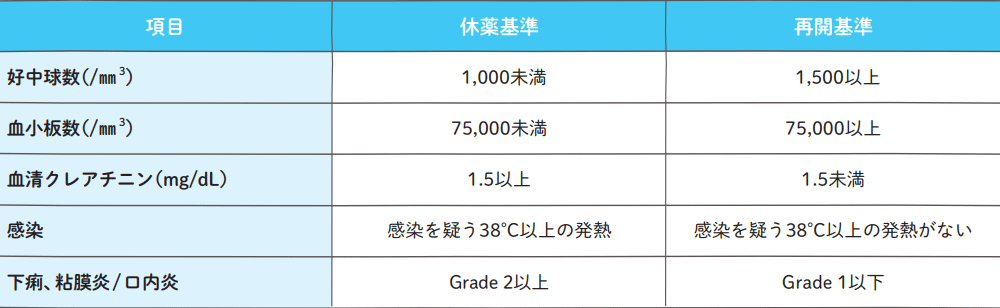
減量・中止基準
治療開始後に有害事象を認めた場合、以下の基準に従う。
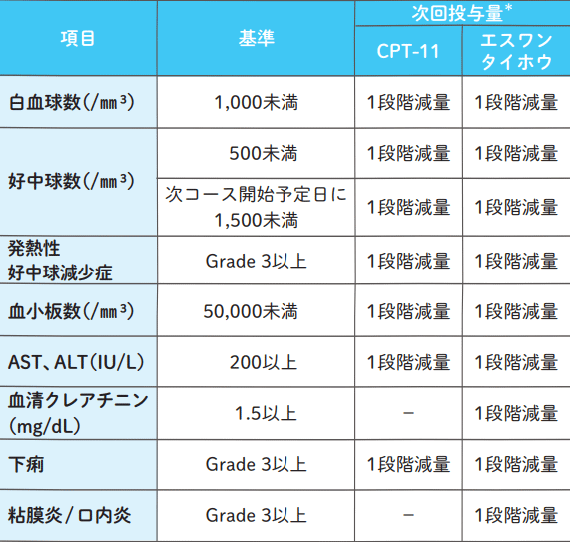
*減量は1段階ずつ、2段階までとする。減量後の再増量は行わない。エスワンタイホウは、2段階減量した後、さらに減量が必要な場合はコースを休止する。その後、症状が軽快/ 回復し、「投与開始基準」をすべて満たすことを確認した場合、2段階減量した用量で再開を考慮する。CPT-11は、2段階減量した後、さらに減量が必要な場合はCPT-11をスキップする。その後、症状が軽快/ 回復し、「投与開始基準」をすべて満たすことを確認した場合、2段階減量した用量で再開を考慮する。
以下のベバシズマブ投与中止基準に1つでも該当した場合、ベバシズマブの投与を中止する。投与を中止した場合、症状が軽快/回復しても以後のベバシズマブの投与再開は行わない。
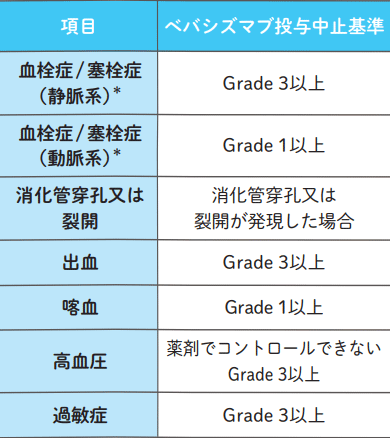
*TRICOLORE 試験ではベバシズマブの血栓症/ 塞栓症の投与中止基準は「Grade 3以上」であったが、最新のアバスチン適正使用ガイド(結腸・直腸)を参考に基準を修正した。
各種基準はTRICOLORE試験の実施計画書から抜粋した。
参考
Komatsu Y, et al. BMC Cancer. 2015; 15: 626
Yamada Y, et al. Ann Oncol. 2018; 29(3): 624-631
切除不能大腸癌1次治療におけるS-1、irinotecan、bevacizumab併用療法の有用性を検証する臨床第Ⅲ相試験
各基準におけるGradeはCTCAE v4.0に準拠
エスワンタイホウの使用にあたっては用法及び用量をご参照ください。

