有害事象/副作用発現率、発現時期及び適正使用の目安
エスワンタイホウ+内分泌療法剤〈ホルモン受容体陽性かつHER2陰性で再発高リスクの乳癌における術後薬物療法〉
主な有害事象発現率(n=954)
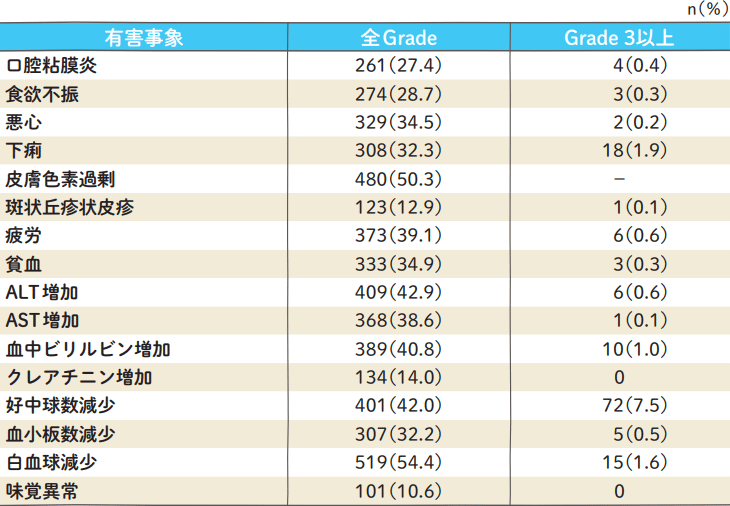
Grade分類は、CTCAE v4.0で集計
Toi M, et al. Lancet Oncol. 2021; 22(1):74-84(ティーエスワンの承認時評価資料)
エストロゲン受容体陽性HER2陰性乳癌に対するS-1術後療法ランダム化比較第Ⅲ相試験,大鵬薬品工業(株)社内資料(2022)(ティーエスワンの承認時評価資料)
エスワンタイホウの投与開始基準
臨床検査値及び臨床所見が全て満たすことを確認した上で、投与を開始する。
投与開始基準を満たさない場合には、投与開始基準を満たすことを確認するまで、投与開始を延期する。
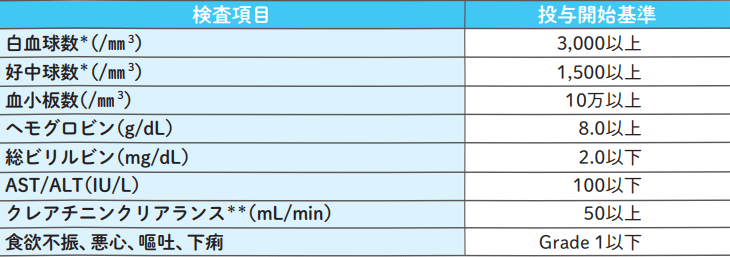
*:白血球数又は好中球数いずれかを満たしていること。
**:各コース開始時のクレアチニンクリアランスが登録時の値から変動した場合も、投与開始基準を満たしている場合は、登録時の投与量で継続可とする。
エスワンタイホウ休薬の目安・減量基準
エスワンタイホウ投与中に臨床検査、診察を行った際は、コース中の休薬の目安を参考に、投与継続又は休薬を考慮する。
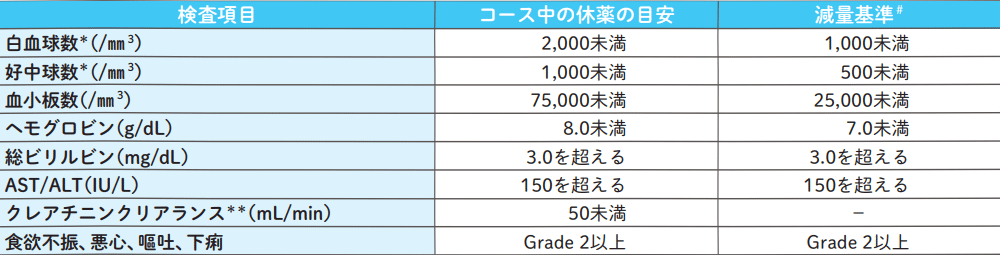
*:白血球数又は好中球数いずれかを満たしていること。
**:各コース開始時のクレアチニンクリアランスが登録時の値から変動した場合も、投与開始基準を満たしている場合は、登録時の投与量で継続可とする。
#:一過性であると担当医が判断した場合、次コース以降での発現状況を確認してからの減量も可とする。
エスワンタイホウの投与量
減量基準に抵触する有害事象が発現した場合はエスワンタイホウを休薬し、投与開始基準に回復した後、減量投与量に従って、1段階減量して投与を再開する。
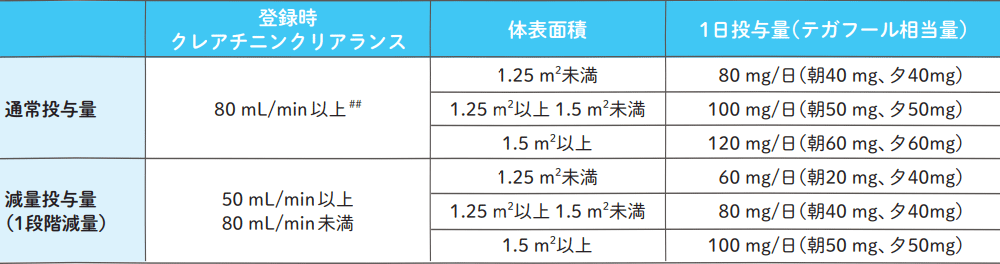
##:クレアチニンクリアランスが80 mL/min 以上の場合でも、前治療の影響が残っている症例、年齢又は全身状態等を考慮し、担当医の判断により1段階減量から開始することも可とする。
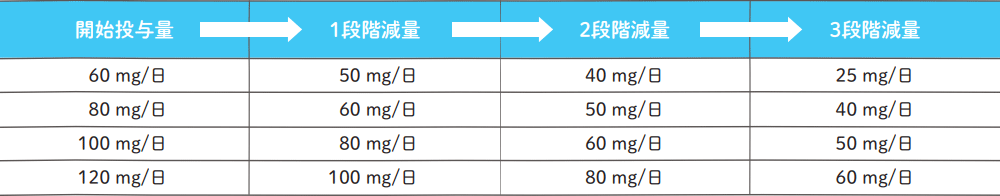
エスワンタイホウの減量投与量
1段階減量しても同じ毒性が認められた場合にはさらに減量することができるが、3段階減量しても減量基準に抵触する有害事象が発現した場合は、さらなる減量は行わず治療を中止する。
参考
Toi M, et al. Lancet Oncol. 2021; 22(1): 74-84(ティーエスワンの承認時評価資料)
エストロゲン受容体陽性HER2陰性乳癌に対するS-1術後療法ランダム化比較第Ⅲ相試験,大鵬薬品工業(株)社内資料(2022)(ティーエスワンの承認時評価資料)
各基準におけるGradeはCTCAE v4.0に準拠
エスワンタイホウの使用にあたっては用法及び用量をご参照ください。

